SALVATAGGIO DEGLI ARTI INFERIORI: ANGIOGENESI TERAPEUTICA NELL'ISCHEMIA CRITICA
Angiogenesi terapeutica con cellule staminali e fattori di crescita nell'ischemia critica degli arti inferiori
L’angiogenesi terapeutica rappresenta una delle più recenti conquiste della ricerca in campo vascolare tesa ad aprire nuove vie al trattamento della patologia ischemica coronarica e periferica degli arti inferiori.
A cura del Prof. Antonio La RosaSpecialista in Chirurgia Vascolare. Chirurgia Sperimentale, Microchirurgia.
Università degli Studi di Pavia
Cell.339/7994760
Tel.0382/24179
L’angiogenesi terapeutica è una terapia rigenerativa finalizzata allo sviluppo di nuovi vasi per incrementare il flusso ematico in aree scarsamente vascolarizzate e ad alto rischio di lesioni ischemiche. Detta terapia trova indicazione nei negli stadi più avanzati della patologia ostruttiva aterosclerotica e diabetica periferica in Pazienti quindi con quadro di ischemia critica degli arti inferiori e particolarmente in quelli non suscettibili di interventi di rivascolarizzazione o già sottoposti ad essi con insuccesso. Clinicamente l’ischemia critica risulta caratterizzata da claudicatio intermittens” con una autonomia di marcia limitata a pochissimi metri, dolore ischemico notturno, arti freddi, distrofie cutanee, ulcere plantari (es. piede diabetico) o nei casi più gravi (IV° stadio di Fontane), lesioni necrotico-gangrenose più o meno estese.
Come già riferito a proposito del trattamento locoregionale dell’ischemia critica degli arti inferiori è possibile ottenere frequentemente un efficace incremento di flusso nell’arto attraverso la mediazione del circolo collaterale che funge da by pass naturale alle ostruzioni arteriose aterosclerotiche con conseguente risoluzione del dolore ischemico e guarigione anche di ulcere cutanee complesse (Figura 1). Di contro un circolo collaterale considerevolmente povero potrà non consentire l’adeguato incremento di flusso necessario al recupero dello stato di ischemia critica; altresì territori a valle di lesioni ostruttive con povertà di circolo capillare valido rappresentano le condizioni di maggiore difficoltà al recupero dell’arto. In tali circostanze il ricorso all’Angiogenesi Terapeutica sembra offrire promettenti risultati. Previa introduzione alla tematica dell’angiogenesi terapeutica e descritti i principali meccanismi d’azione dei fattori di crescita vascolare e delle cellule staminali, si riferisce sulla personale esperienza nell’impiego dell’Angiogenesi Terapeutica nel trattamento dell’ischemia critica degli arti inferiori.
Angiogenesi terapeutica: introduzione
L’angiogenesi, ovvero lo sviluppo di nuovi vasi, rappresenta un evento fisiologico che si manifesta in molteplici situazioni come lo sviluppo dell’embrione ed è presente in tutti gli eventi riparativi dei tessuti danneggiati da traumi o patologie degenerative. E’ spesso la capacità angiogenetica del nostro organismo a condizionare la guarigione di diverse patologie. La possibilità di intervenire attraverso l’angiogenesi terapeutica, ovvero stimolare lo sviluppo di nuovi vasi, tra cui anche il circolo collaterale, rappresenta una grande speranza per la risoluzione dei casi più gravi di ischemia critica degli arti inferiori. Quest’ultima risulta gravata, con l’impiego di tecniche convenzionali, da un tasso di amputazione pari al 50% (1).
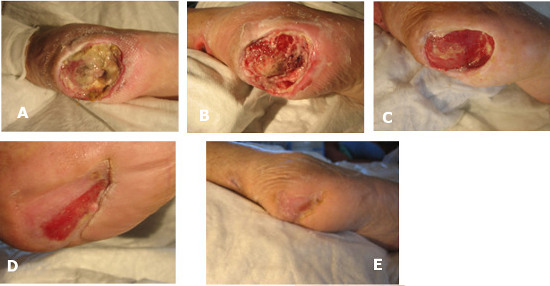
Caso 1: F.L. 86 anni. A: estesa ulcera del calcagno in Pz.te con ischemia critica arto inferiore DX. B: dopo debridement a ultrasuoni (presenza di osso calcaneale esposto). C: al 32° giorno dall’inizio terapia con trattamento locoregionale vasoattivo e angiogenesi terapeutica. D: al 75° giorno dall’inizio terapia. E: completa guarigione al 105° giorno.
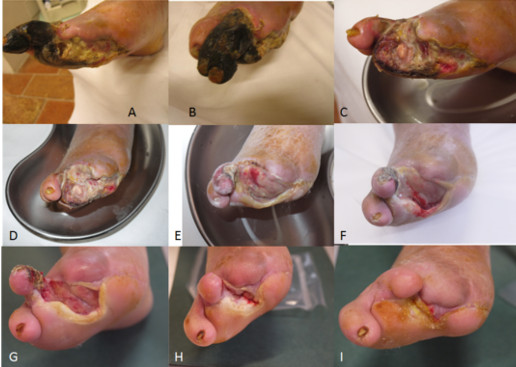
Caso 2: C.E. 65 anni. Gangrena su base aterosclerotica piede DX in Pzte già sottoposto a 2 rivascolarizzazioni con angioplastica + stent e ad amputazione del I°dito. A – B: quadro lesionale del Pzte con indicazione chirurgica, posta altrove, di amputazione di coscia per inattuabilità di ulteriori interventi di rivascolarizzazione. C – D: al 3°mese dall’inizio della terapia con trattamenti locoregionali vasoattivi, disarticolazione II°e III°dito, debridement ad ultrasuoni ed applicazione di membrane collageniche. E-F: al 4°e 5°mese di trattamento locoregionale vasoattivo, applicazione di membrane collageniche e trattamenti locoregionali con fattori di crescita. G-H: fasi di avanzata guarigione al 6°e 9°mese di cura. I: completa risoluzione del quadro all’11°mese di trattamento.
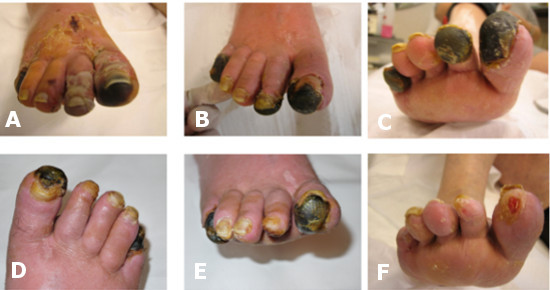
Caso 3: P.A. 55 anni. Ischemia critica su base aterosclerotica arto inferiore DX con lesioni necrotiche al I°, II° e V° dito del piede in fase evolutiva . A: al momento della prima osservazione dopo recente trattamento infruttuoso di trombolisi loco regionale eseguito altrove, con impraticabilità angiografica all’esecuzione di intervento di rivascolarizzazione tramite PTA o by pass. La Pzte è stata subito sottoposta al primo trattamento locoregionale vasoattivo. B: al 46° giorno dall’inizio del trattamento locoregionale vasoattivo e di angiogenesi terapeutica con arresto della progressione della malattia, netta demarcazione delle lesioni e recupero trofico del piede. C: al 50° giorno di trattamento locoregionale di angiogenesi terapeutica. D-E: al 4°mese di trattamento segni di avvenuta rigenerazione tessutale a carico del I° e II° dito e caduta parziale dell’area necrotica. F: al 6° mese con completa rigenerazione tessutale a carico del I° e II° dito e caduta spontanea della falange distale del V° dito.
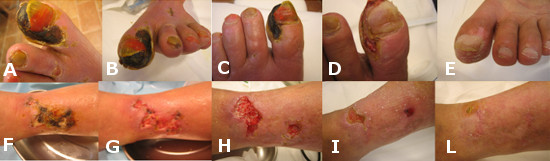
Caso 4: S.E. 78 anni. Pz.te con ischemia critica arto inferiore SX, già amputato di coscia a DX. A-B-F: al momento della prima osservazione: necrosi a carico del I° dito e ulcera cutanea sulla faccia laterale di gamba al suo terzo inferiore. G: dopo debridement ad ultrasuoni con Genera Ultrasonic . C-H: al 2° mese di cura dopo 4 trattamenti vasoattivi locoregionali e 2 di angiogenesi terapeutica. D-I: al 3° mese e mezzo di cura: fase di avanzata guarigione a carico del primo dito e dell’ulcera cutanea. E-L: completa guarigione al 5° mese e mezzo.
-----------------------------------------------------------------------------------
Con il termine Angiogenesi si comprende: Arteriogenesi, Vasculogenesi e Angiogenesi propriamente detta che rappresentano tre differenti aspetti integrati in un unico processo. Con Angiogenesi si definisce il processo di formazione di nuovi capillari che prendono origine in seguito ad attivazione e migrazione delle cellule di rivestimento della parete interna dei vasi, cellule endoteliali, da capillari preesistenti (Figura 1).
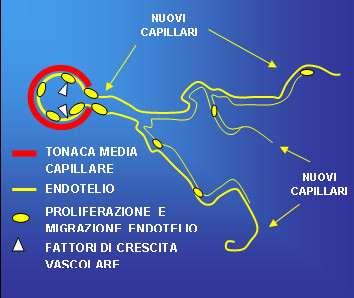
Figura 1: Angiogenesi con attivazione, proliferazione e migrazione di cellule endoteliali da capillare preesistente
-----------------------------------------------------------------------------------
Tale processo di germinazione capillare, e in particolare la proliferazione e migrazione dell’endotelio, prende avvio dallo stato di ipossia ( bassa concentrazione di ossigeno) dei tessuti. Quest’ultima, tramite l’attivazione dell’hypoxia- inducible factor 1 (HIF-1?), rappresenta un forte stimolo alla azione angiogenica di fattori di crescita* come il fattore di crescita vascolare endoteliale A (VEGF). La proliferazione delle cellule endoteliali nei tessuti circostanti porta alla formazione di nuovi tubuli capillari che verranno successivamente stabilizzati da periciti e cellule muscolari lisce.
La Vasculogenesi è definita come formazione di nuovi capillari per l’intervento di cellule staminali mesenchimali indifferenziate indicate come cellule progenitrici endoteliali (EPCs). Tale evento avviene fisiologicamente durante lo sviluppo embrionale, nell’adulto per migrazione delle EPCs nelle aree ischemiche ma può essere oggi anche indotto a scopo terapeutico (2-3-4). Le EPCs sono presenti nel sangue circolante e prodotte dal midollo osseo e quelle dimostratesi essere coinvolte nella vasculogenesi dell’adulto sono identificabili per dei marcatori di superficie identificati come CD34.
L’Arteriogenesi riguarda lo sviluppo di collaterali da arteriole preesistenti che vanno incontro ad un aumento di diametro; ciò si traduce nella formazione di un circolo collaterale, a monte della zona ischemica, avente la funzione di superare gli ostacoli rappresentati dalle occlusioni aterosclerotiche fungendo da by pass naturali. Lo stimolo all’innesco di tale processo risulta essere prevalentemente dipendente da fattori infiammatori come il monocyte chemoattractant protein-1 (MCP-1) piuttosto che fattori ipossici (HIF-1?) o di crescita (VEGF) come invece avviene per vasculogenesi e angiogenesi. Inoltre il fenomeno di shear stress o stimolo meccanico tangenziale alle pareti arteriose di preesistenti arteriole può attivare tramite l’ICAM-1 l’adesione e trasmigrazione di leucociti con conseguente effetto finale di aumento delle cellule muscolari lisce della parete e loro incremento in spessore.
Angiogenesi terapeutica nell’ischemia critica: fattori di crescita e cellule staminali
Fattori di crescita
Numerosi fattori di crescita e citochine hanno mostrato potenzialità di promuovere angiogenesi, vasculogenesi e arteriogenesi in colture cellulari, in modelli animali e nell’uomo affetto da ischemia critica degli arti inferiori (5-6-7-8-9-10-11-12-13-14-15-16). L’arteriogenesi ovvero la crescita di vasi collaterali che arricchiscono un circolo collaterale poco valido, rappresenta uno dei fattori principali per l’incremento del flusso in un arto più che lo sviluppo di un circolo capillare. In accordo infatti con la legge di Poiseuille vasi di medio calibro come il circolo collaterale risultano emodinamicamente più validi di vasi di piccolo calibro come il circolo capillare e, da quanto si rileva in clinica, spesso determinanti nella risoluzione di stati di ischemia critica.
Pertanto la stimolazione alla crescita vascolare dovrebbe essere primariamente rivolta comunque al circolo collaterale al fine di incrementare l’inflow ovvero l’afflusso ematico all’arto. E’ comunque fondamentale,oltre all’afflusso ematico, assicurare la possibilità degli scambi gassosi cellulari attraverso l’angiogenesi capillare in tessuti che risultino poveri di circolo capillare valido o danneggiato dallo stato di ischemia critica.

Figura 2: Alcuni tra i più importanti fattori di crescita risultati efficaci sperimentalmente in vivo sulla stimolazione dell’angiogenesi, vasculogenesi ed arteriogenesi
-----------------------------------------------------------------------------------
I fattori di crescita, attraverso varie vie, contribuiscono alla formazione di nuovi vasi che vascolarizzano aree ipoperfuse consentendo la riparazione dei tessuti. Tra i fattori di crescita il VEGF, il FGF e l’Eritropoietina sono certamente i più studiati; comunque per tutti il grado di risposta angiogenica è dipendente dal grado di espressione cellulare dei loro recettori.
L’impiego dei fattori di crescita vascolari a scopo terapeutico contempla una loro somministrazione nella zona ischemica o nel circolo sistemico sia come proteine ricombinanti sia sotto forma di geni codificanti la glicoproteina (es. VEGF) in forma diretta o veicolati tramite vettori virali o non virali (terapia genica).
Cellule staminali
Le cellule progenitrici endoteliali circolanti (EPCs), cellule staminali mesenchimali derivate dal midollo osseo e identificate da marcatori di superficie come CD34+, sono state riconosciute in grado di riparare i danni della rete vascolare attraverso l’innesco della angiogenesi (17) . Il ruolo delle cellule staminali nella neovascolarizzazione è comunque ancora da definirsi specialmente riguardo il loro inglobamento nei neovasi e la loro azione di rinforzo sull’angiogenesi per secrezione di citochine e fattori di crescita compreso il VEGF e l’FGF-2 che appare uno tra i meccanismi prevalenti legati alla loro capacità angiogenica. L’applicazione attualmente più seguita, dopo l’esperienza pionieristica di Tateishi-Yuyama e collaboratori pubblicata nel 2002 (2), riguardante l’impiego delle cellule staminali a scopo terapeutico nell’ischemia periferica ,contempla l’utilizzo di cellule progenitrici endoteliali prelevate dal midollo osseo della cresta iliaca del Paziente e somministrate direttamente in sede ischemica (18 ).
Cellule endoteliali e cellule infiammatorie
Come già evidenziato le cellule endoteliali sono i vettori dell’angiogenesi e stimolate da fattori di crescita, come il VEGF, proliferano formando microtubuli capillari. Oltre alle cellule endoteliali ed alle cellule staminali, anche numerose cellule di tipo infiammatorio si è dimostrato svolgano un ruolo importante nella neoangiogenesi come i monociti, cellule T, neutrofili, mast cells e dendritic cells attraverso la produzione di citokine e proteinasi.
Trial clinici
Numerosi trial clinici di Pz. ti affetti da arteriopatia periferica in ischemia critica e trattati con fattori di crescita, prevalentemente con VEGF, e con cellule staminali selezionate da midollo osseo dello stesso paziente sono stati pubblicati a partire rispettivamente dal 1998 (18-19-20-21-22) e dal 2002 ai giorni nostri (3-4-23-24-26). Nonostante la discreta variabilità di risultati riguardo l’impiego dei fattori di crescita, i più recenti riscontri indicano che l’impiego del VEGF è in grado di promuovere la guarigione di ulcere cutanee e migliorare lo stato emodinamico in Pz. ti diabetici affetti da ischemia critica (22). Anche le più recenti comunicazioni riguardo l’impiego delle cellule staminali prelevate da midollo osseo dello stesso Pz.te risultano particolarmente incoraggianti per il trattamento di Pz. ti in ischemia critica non trattabili convenzionalmente con effetti positivi anche su ulcere cutanee (25).
Angiogenesi Terapeutica nell’ischemia critica degli arti inferiori: esperienza personale
L’esperienza personale inerente l’angiogenesi terapeutica riguarda il trattamento di Pz. ti in ischemia critica sia in assenza di lesioni necrotiche ma con evidenza clinica di alta probabilità ad un loro manifestarsi, sia con iniziali lesioni trofiche (necrosi o ulcere cutanee) e non suscettibili di interventi di rivascolarizzazione chirurgica convenzionale o endovascolare o già sottoposti con insuccesso a terapia rivascolarizzante.
L’angiogenesi terapeutica, nella personale esperienza, viene attuata con impiego di fattore di crescita endoteliale e sempre associata al trattamento locoregionale. Quest’ultimo ha infatti la finalità di ottenere prontamente una significativa riduzione o cessazione del dolore ischemico associato ad un incremento della perfusione dell’arto attraverso la risposta vasodilatatoria periferica.
Il ricorso all’angiogenesi terapeutica risulta invece fondamentale nel contrastare il manifestarsi di lesioni trofiche o l’avanzamento dei processi necrotici e gangrenosi già presenti, alle restanti porzioni del piede o della gamba attraverso due meccanismi:
- il primo, ed il più immediato, deriva dall’effetto di protezione sui tessuti svolto da alcuni fattori di crescita riguardo l’insulto ischemico e inibitorio di apoptosi cellulare in grado di evitare o ridurre del 50% la necrosi in aree sottoposte ad ischemia (27, 28 ).
- il secondo meccanismo positivo di ostacolo all’estensione dei processi necrotici compare più tardivamente e risulta dipendente dalla vera e propria azione angiogenetica ovvero di sviluppo di nuovi capillari in aree tessutali che ne risultano povere o siano state danneggiate dall’insulto ischemico.
La non limitazione dell’estensione del processo necrotico o di gangrena comporta un’alta percentuale di rischio di amputazione dell’arto.
L’azione combinata del trattamento vasoattivo locoregionale associato ad angiogenesi terapeutica si propone quindi di prevenire il manifestarsi di lesioni ischemiche in pazienti affetti da ischemia critica degli arti inferiori e in quelli in cui siano già presenti lesioni ischemiche, evitarne l’estensione riducendo così l’incidenza di amputazioni maggiori.
________________________________________
References
Prof. Antonio La Rosa
Bibliografia
1. Norgren L, Hiatt WR, Dormandy JA, Nehler MR, Harris KA, Fowkes FG, Bell K, Caporusso J, Durand-Zaleski I, Komori K, Lammer J, Liapis C, Novo S, Razavi M, Robbs J, Schaper N,
Shigematsu H, Sapoval M, White C, White J. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). Eur J Vasc Endovasc Surg. 2007;33 Suppl 1:S1-75.
2. Tateishi-Yuyama E, Matsubara H, Murohara T, Ikeda U, Shintani S, Masaki H, Amano K, Kishimoto Y, Yoshimoto K, Akashi H, Shimada K, Iwasaka T, Imaizumi T. Therapeutic angiogenesis for patients with limb ischemia by autologous transplantation of bone-marrow cells: a pilot study and a randomised controlled trial. Lancet. 2002;360:427-435.
3. Miyamoto M, Yasutake M, Takano H, Takagi H, Takagi G, Mizuno H, Kumita S, Takano T. Therapeutic angiogenesis by autologous bone marrow cell implantation for refractory chronic peripheral arterial disease using assessment of neovascularization by 99mTc-tetrofosmin (TF) perfusion scintigraphy. Cell Transplant. 2004;13:429-437.
4. Saito Y, Sasaki K, Katsuda Y, Murohara T, Takeshita Y, Okazaki T, Arima K, Katsuki Y, Shintani S, Shimada T, Akashi H, Ikeda H, Imaizumi T. Effect of autologous bone-marrow cell transplantation on ischemic ulcer in patients with Buerger’s disease. Circ J. 2007;71:1187-1192.
5. Takeshita S, Zheng LP, Brogi E, Kearney M, Pu LQ, Bunting S, Ferrara N, Symes JF, Isner JM. Therapeutic angiogenesis. A single intraarterial bolus of vascular endothelial growth factor augments revascularization in a rabbit ischemic hind limb model. J Clin Invest. 1994;93:662-670.
6. Van Weel V, Deckers MM, Grimbergen JM, van Leuven KJ, Lardenoye JH, Schlingemann RO, Nieuw Amerongen GP, van Bockel JH, van Hinsbergh VW, Quax PH. Vascular endothelial growth factor overexpression in ischemic skeletal muscle enhances myoglobin expression in vivo. Circ Res. 2004;95:58-66.
7. Rissanen TT, Markkanen JE, Gruchala M, Heikura T, Puranen A, Kettunen MI, Kholova I, Kauppinen RA, Achen MG, Stacker SA, Alitalo K, Yla-Herttuala S. VEGF-D is the strongest angiogenic and lymphangiogenic effector among VEGFs delivered into skeletal muscle via adenoviruses. Circ Res. 2003;92:1098-1106.
8. Hiasa K, Ishibashi M, Ohtani K, Inoue S, Zhao Q, Kitamoto S, Sata M, Ichiki T, Takeshita A, Egashira K. Gene transfer of stromal cell-derived factor-1alpha enhances ischemic vasculogenesis and angiogenesis via vascular endothelial growth factor/endothelial nitric oxide synthase-related pathway: next-generation chemokine therapy for therapeutic neovascularization. Circulation. 2004;109:2454-2461.
9. Asahara T, Bauters C, Zheng LP, Takeshita S, Bunting S, Ferrara N, Symes JF, Isner JM. Synergistic effect of vascular endothelial growth factor and basic fibroblast growth factor on angiogenesis in vivo. Circulation. 1995;92:II365-II371.
10. Shyu KG, Manor O, Magner M, Yancopoulos GD, Isner JM. Direct intramuscular injection of plasmid DNA encoding angiopoietin-1 but not angiopoietin-2 augments revascularization in the rabbit ischemic hindlimb. Circulation. 1998;98:2081-2087.
11. Taniyama Y, Morishita R, Aoki M, Nakagami H, Yamamoto K, Yamazaki K, Matsumoto K, Nakamura T, Kaneda Y, Ogihara T. Therapeutic angiogenesis induced by human hepatocyte growth factor gene in rat and rabbit hindlimb ischemia models: preclinical study for treatment of peripheral arterial disease. Gene Ther. 2001;8:181-189.
12. Rabinovsky ED, Draghia-Akli R. Insulin-like growth factor I plasmid therapy promotes in vivo angiogenesis. Mol Ther. 2004;9:46-55.
13. Ozawa T, Toba K, Kato K, Minagawa S, Saigawa T, Hanawa H, Makiyama Y, Moriyama M, Honma KI, Isoda M, Hasegawa G, Naito M, Takahashi M, Aizawa Y. Erythroid cells play essential roles in angiogenesis by bone marrow cell implantation. J Mol Cell Cardiol. 2006;40:629-638.
14. Vincent KA, Shyu KG, Luo Y, Magner M, Tio RA, Jiang C, Goldberg MA, Akita GY, Gregory RJ, Isner JM. Angiogenesis is induced in a rabbit model of hindlimb ischemia by naked DNA encoding an HIF-1alpha/VP16 hybrid transcription factor. Circulation. 2000;102:2255-2261.
15. Khachigian LM. Early growth response-1 in cardiovascular pathobiology. Circ Res. 2006;98:186-191.
16. Hong KH, Ryu J, Han KH. Monocyte chemoattractant protein-1-induced angiogenesis is mediated by vascular endothelial growth factor-A. Blood. 2005;105:1405-1407.
17.Masataka S. Role of circulating vascular progenitors in angiogenesis, vascular healing, and pulmonary hypertension. Arteriosclerosis, Trombosis and Vascular Biology. 2006;26:1008.
18. Yousuke k, Yoshiaki T, Ken A, Yutaka S, Ken-ichiro S, Shinichi S, Toyoaki Murohara, Tsutomu I. Effect of bone marrow transplantation in patients with critical limb ischemia.Cardiovascular regeneration therapies using tissue engineering approaches( Book). Springer Tokio- 2005; 5:213-220.
19. Baumgartner I, Pieczek A, Manor O, Blair R, Kearney M, Walsh K, Isner JM. Constitutive expression of phVEGF165 after intramuscular gene transfer promotes collateral vessel
development in patients with critical limb ischemia. Circulation. 1998;97:1114-1123.
20. Kim HJ, Jang SY, Park JI, Byun J, Kim DI, Do YS, Kim JM, Kim S, Kim BM, Kim WB, Kim DK. Vascular endothelial growth factor-induced angiogenic gene therapy in patients with peripheral artery disease. Exp Mol Med. 2004;36:336-344.
21. Morishita R, Aoki M, Hashiya N, Makino H, Yamasaki K, Azuma J, Sawa Y, Matsuda H, Kaneda Y,Ogihara T. Safety evaluation of clinical gene therapy using hepatocyte growth factor to treat peripheral arterial disease. Hypertension. 2004;44:203-209.
22. Kusumanto YH, van Weel V, Mulder NH, Smit AJ, van den Dungen JJ, Hooymans JM, Sluiter WJ,Tio RA, Quax PH, Gans RO, Dullaart RP, Hospers GA. Treatment with intramuscular vascular endothelial growth factor gene compared with placebo for patients with diabetes mellitus and critical limb ischemia: a double-blind randomized trial. Hum Gene Ther. 2006;17:683-691.
23. Kipshidze N, Kipiani K, Beridze N, Roubin G, Tsapenko M, Shehzad MZ, Moses J, Kipshidze NN.Therapeutic angiogenesis for patients with limb ischemia by utilization of fibrin meshwork. Pilot randomized controlled study. Int Angiol. 2003;22:349-355.
24. Tateishi-Yuyama E, Matsubara H, Murohara T, Ikeda U, Shintani S, Masaki H, Amano K, Kishimoto Y, Yoshimoto K, Akashi H, Shimada K, Iwasaka T, Imaizumi T. Therapeutic
angiogenesis for patients with limb ischemia by autologous transplantation of bone-marrow cells: a pilot study and a randomised controlled trial. Lancet. 2002;360:427-435.
25. Bartsch T, Brehm M, Zeus T, Strauer BE. Autologous mononuclear stem cell transplantation in patients with peripheral occlusive arterial disease. J Cardiovasc Nurs. 2006;21:430-432.
26. Kajiguchi M, Kondo T, Izawa H, Kobayashi M, Yamamoto K, Shintani S, Numaguchi Y, Naoe T,Takamatsu J, Komori K, Murohara T. Safety and efficacy of autologous progenitor cell transplantation for therapeutic angiogenesis in patients with critical limb ischemia. Circ J. 2007;71:196-201.
27. K Nayan S Rao, Azan S Brinbrek, Burton E Sobel. Heart disease and erythropoietin. Future Cardiol. 2008; 4(1):57-64.
28. Parsa CJ, Matsumoto A, Kim J Riel RU, Pascal LS, Walton GB, Thompson RB, Petrofski JA, Annex BH, StamlerJS, Koch WJ. A novel protective effect of erythropoietin in the infracted heart. J Clin Invest 112:999-1007,2003.