Il medico di medicina generale e la nefropatia diabetica
In Italia si stima una prevalenza media del diabete di tipo 2 pari al 5-6,5% (secondo alcuni autori il 8-9%). L’incidenza è di 3-6/ mille/anno. Attualmente nel mondo si stimano più di 160 milioni di diabetici, 146 milioni dei quali di tipo 2 (NIDDM). Il 20-30% dei diabetici NIDDM sviluppa nefropatia.
La nefropatia diabetica è clinicamente definita, nella sua fase conclamata, dalla presenza di proteinuria persistente. L’escrezione urinaria di proteine superiore a 500 mg nelle 24 ore (o l’albuminuria superiore a 300 mg nelle 24 ore o superiore a 200 μg/min) e il progressivo declinare del filtrato glomerulare si associano ad ipertensione arteriosa, retinopatia diabetica e aumentata morbilità e mortalità cardiovascolare.
Obiettivi: Questa può sembrare una relazione provocatoria perché, aldilà di ogni argomentazione scientifica sul diabete di tipo 2 (dalla fisiopatologia alla terapia), il compito del MMG è quello di concretizzare la medicina basata sulle evidenze, per migliorare la qualità di vita e la sopravvivenza dei suoi pazienti.
Diabete e insufficienza renale terminale: Dimensioni del problema
La cardiopatia ischemica e l’interessamento della carotide sono causa del 50% della mortalità della popolazione diabetica e più precisamente del 70% dei diabetici di tipo 2 e del 20% dei diabetici di tipo 1. La retinopatia diabetica è responsabile del 13% di tutti i casi di cecità ed è la prima causa di cecità nei soggetti di età inferiore a 40 anni. L’insufficienza renale come complicanza del diabete è un problema ancora più rilevante per la sanità pubblica italiana e mondiale (tab.1).
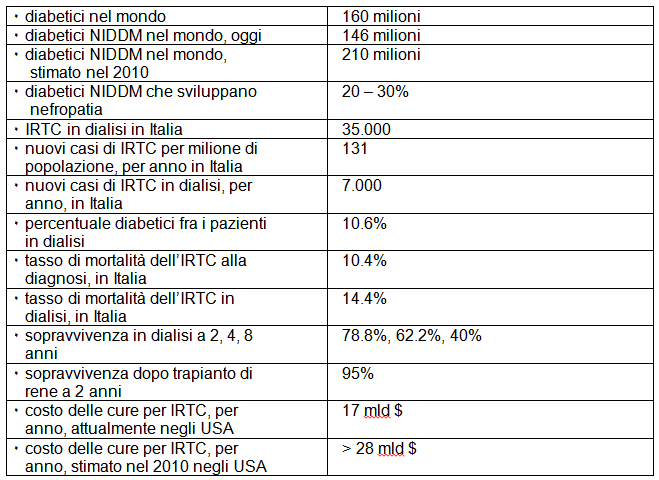
L’incidenza della condizione di insufficienza renale cronica allo stadio terminale (IRTC) come complicanza della malattia diabetica è infatti in continuo aumento nei paesi industrializzati. Dal Registro Italiano di Dialisi e Trapianto un’indagine epidemiologica condotta nel 1995 mostrava 773 casi di Insufficienza Renale Terminale Cronica (IRTC) per milione/abitante, con 133 casi nuovi per anno (1). In uno studio del 1999 della Società Nefrologica Apulo-Lucana risultano in Puglia e Basilicata circa 4000 pazienti in dialisi e trapianto su una popolazione residente di 4.500.000: vi è una incidenza di 900/1.000.000 (2). Nel 2005 si prevede un caso per mille/abitanti. Uno su dieci dei dializzati (10.6%) vede nel diabete la causa primaria della perdita della funzione renale.
Questi dati hanno fatto parlare di vera e propria “epidemia” di IRTC, in particolare nella popolazione oltre i 65 anni. Poiché la sopravvivenza media degli Italiani è aumentata di ben 5 anni tra il 1980 e il 1999, l’invecchiamento medio della popolazione è senza dubbio uno dei fattori determinanti l’incremento osservato nella IRTC.
Un lavoro condotto sui nostri assistiti oltre i 60 anni mostra una prevalenza di insufficienza renale cronica del 35% (3). Una quota significativa di IRTC, dialisi, trapianti e morti potrebbe essere evitata o differita nel tempo. Poche sono le situazioni in cui il Medico di Medicina Generale (MMG) svolge un ruolo di sanità pubblica così importante come nella prima diagnosi e nel disease management dell’insufficienza renale cronica: è infatti il MMG, e non il nefrologo, la prima figura sanitaria a sospettare, ricercare e riscontrare l’insufficienza renale.
Microalbuminuria: definizione, tecniche di valutazione e fattori influenzanti
Un’aumentata escrezione urinaria di albumina è spesso il primo segnale di nefropatia diabetica. Il primo step diagnostico è pertanto rappresentato dall’esame standard delle urine. Qualora questo risulti normale, l’eventuale presenza di nefropatia incipiente deve essere esclusa misurando l’albuminuria, non rilevabile con i test urinari convenzionali, mediante determinazione quantitativa con metodo radioimmunologico, nefelometrico o immunoturbidimetrico. La modalità di raccolta e il numero di campioni analizzati per ogni paziente sono cruciali per una corretta classificazione.
L’escrezione urinaria giornaliera di albumina è molto variabile in rapporto a varie condizioni sia fisiologiche che patologiche (esercizio fisico, apporto alimentare soprattutto proteico, eventuale presenza di stati infiammatori e infettivi, assunzione di alcuni farmaci). Per minimizzare questi fattori, nel complesso responsabili di variazioni comprese tra il 30 e 50%, si è stabilito di considerare per ogni paziente la media di tre diversi campioni urinari raccolti in tre giorni non consecutivi nell’arco di sei mesi, in assenza di infezioni delle vie urinarie.
Anche le modalità di raccolta urinaria devono essere standardizzate. Le raccolte temporizzate, notturna (overnight) o delle 24h, costituiscono la metodica di riferimento ma risultano indaginose e sgradite ai pazienti e quindi sono spesso gravate da errori o imprecisioni. Pertanto il metodo maggiormente raccomandato per valutazioni di screening è il rapporto albumina/creatinina (ACR) su campioni “spot” delle urine raccolte al risveglio mattutino.
La correzione dell’albuminuria secondo i valori di creatininuria consente di compensare il diverso grado di concentrazione delle urine e la diversa escrezione urinaria di creatinina tra maschi e femmine. Il rapporto ACR è il risultato riproducibile, accurato e altamente correlato con le raccolte temporizzate, pur conservando i vantaggi della raccolta “spot”.
Con questa metodica si definiscono:
- normoalbuminurici i pazienti maschi con ACR < 2.38 mg/mmol e femmine con ACR < 2.96 mg/mmol
- microalbuminurici quelli con ACR compreso tra 2.38 e 19 mg/mmol (maschi) o tra 2.96 e 20 mg/mmol (femmine)
Nei pazienti così sottoposti a screening, l’eventuale presenza di microalbuminuria deve essere confermata con il dosaggio su raccolte temporizzate (AER, albumin excretion rate). Si definisce microalbuminuria un valore di AER compreso tra 20 e 200 μg/min (pari a 30- 300 mg/24h) e macroalbuminuria un valore di AER > 200 μg/min (o 300 mg/24h).
Questi livelli di albuminuria corrispondono per lo più a valori di proteinuria clinicamente rilevabile con test urinari convenzionali (tab. 2).
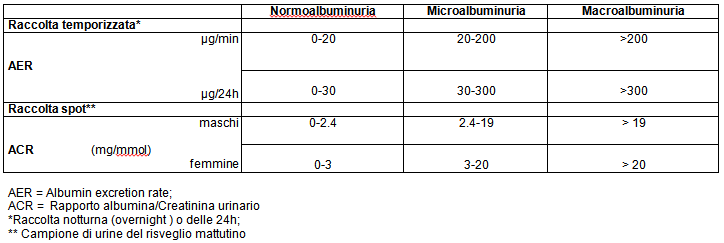
La valutazione periodica dell’albuminuria è fondamentale per la gestione del paziente diabetico a rischio renale. E’ opportuno ricontrollare l’escrezione di ACR o AER annualmente nei pazienti normoalbuminurici e ogni tre -sei mesi in quelli microalbuminurici (fig.1) ( 4 ).

E’ necessario infine ricordare che un’aumentata escrezione urinaria di albumina in presenza di ematuria e/o in assenza di retinopatia diabetica da un lato, e un aumento della creatinina non associata a micro o macroalbuminuria dall’altro, impongono una valutazione nefrologica approfondita per escludere l’esistenza di una possibile nefropatia non diabetica, da verificare eventualmente anche con ricorso alla biopsia renale (5).
Microalbuminuria e iperfiltrazione glomerulare
La storia naturale (6) della nefropatia diabetica è stata ben caratterizzata in quei pazienti con IDDM e NIDDM che sono destinati a sviluppare insufficienza renale (fig.2).
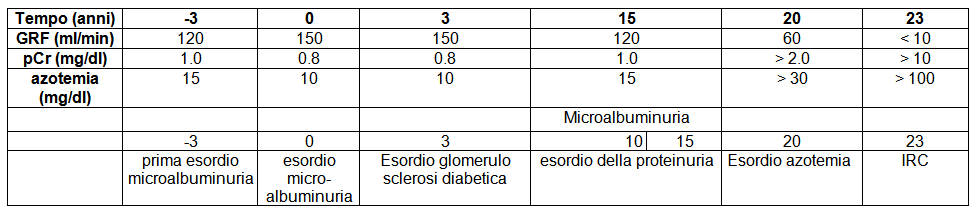
Nel diabete di tipo 1 la microalbuminuria è spesso preceduta o associata a iperfiltrazione glomerulare (7). Nelle fasi che precedono la comparsa della nefropatia (microalbuminuria) il filtrato glomerulare (GFR) è infatti aumentato del 20-50% (8). Quando l’escrezione di albumina è compresa tra 20 e 70 μg/min, l’iperfiltrazione è pressoché costantemente presente. Successivamente, quando l’albuminuria supera i 70 μg/min il GFR tende a diminuire.
Nello studio di Mogensen e Christensen (9,10) albuminuria e GFR aumentano in parallelo fino a valori rispettivamente di 30 μg/min e 150 ml/min; da questo momento il GFR comincia a diminuire riportandosi entro il range di normalità (11). Studi prospettici mostrano che il GFR rimane a livelli normali o stabilmente superiori alla norma (iperfiltrazione) per almeno 5-8 anni nei diabetici di tipo 1 con microalbuminuria persistente se non compare la nefropatia conclamata (12,13). Alla comparsa della proteinuria il GFR è ancora nel range di normalità (14) e per storia naturale tende a declinare di 10 – 15 ml/min/anno (range 0-20 ml/min/anno) quando l’albuminuria aumenta oltre i 300 mg/24h. Il rapporto tra iperfiltrazione, successivo aumento dell’albuminuria e sviluppo della nefropatia suggerito da indagini retrospettive e da studi di follow-up e in maniera più convincente da Rudberg e coll.(15), non è stato confermato da altri autori (16). Nonostante questo, l’iperfiltrazione, associata alla microalbuminuria e a livelli di pressione arteriosa modestamente aumentati è predittivo di patologia renale.
Dati controversi riguardano la presenza di iperfiltrazione nel diabete di tipo 2.
Iperfiltrazione, significativamente correlata ai valori glicemici, è stata descritta nel 21% dei diabetici tipo 2 non proteinurici (17). Recentemente, un aumentato GFR è stato descritto in 158 diabetici di tipo 2 microalbuminurici (18). I diabetici tipo 2, ad elevato rischio di nefropatia in quanto microalbuminurici, hanno nell’iperfiltrazione glomerulare un ulteriore fattore di rischio di progressione. A differenza di quanto descritto nel diabete tipo 1, il GFR si riduce significativamente non solo nei soggetti con proteinuria (0.61 ml/min/mese), ma anche nei microalbuminurici (0.20 ml/min/mese) mentre rimane stabile nei normoalbuminurici (19). Nei microlbuminurici, la riduzione del GFR correla con l’aumentare della pressione arteriosa, dell ’HbA1c e con l’età (19).
Gestione del paziente diabetico tipo 2
La contemporanea presenza di diabete e ipertensione può instaurare un circolo vizioso caratterizzato da danno renale progressivo e aumento della pressione arteriosa con retinopatia, caratterizzanti la microangiopatia diabetica. Nella nostra pratica quotidiana il paziente diabetico è facilmente controllabile attraverso l’esecuzione di alcuni parametri basilari: creatininemia, peso, altezza, età anagrafica, microalbuminuria e pressione arteriosa. Per il filtrato glomerulare, oltre al parametro standard della clearance della creatinina (la raccolta delle urine delle 24h può essere difficoltosa per gli anziani), pertanto esistono delle formule per studiare il eGFR (MDRD-2, CKD-Epi, Cockroft-Gault, Mayo-Clinic, formula BCM*0,50). La Mayo-Clinic e la Cockroft-Gault sono quelle che più si avvicinano; in quanto nella prima è stato dimostrato che nei pazienti affetti da diabete mellito l’equazione quadratica della Mayo Clinic, pur mostrando nel complesso un’accuratezza simile a quella della MDRD, permette di stimare la funzionalità renale in maniera più precisa per alti valori di filtrato glomerulare. Nella seconda al numeratore viene inclusa il peso corporeo come espressione della massa muscolare, ma sovrastima la clearance nei soggetti sovrappeso/obesi. In tal modo si ottengono valori della clearance della creatinina sovrapponibili al metodo standard della raccolta delle urine nelle 24h. Pertanto in presenza di GFR 120 ml/m (in calo), microalbuminuria, ipertensione arteriosa e retinopatia il paziente deve essere trattato farmacologicamente (4).
Terapia della nefropatia diabetica
Nelle Linee guida della società Italiana di Nefrologia (4) gli inibitori del sistema renina-angiotensina (ACEi) sono i farmaci maggiormente usati in quanto:
- Riducono i livelli sierici dei lipidi
- Inibiscono l’accumulo mesangiale di macromolecole
- Diminuiscono l’espansione della matrice mesangiale
- Aumentano l’attività fibrinolitica e la degradazione della matrice mesangiale e l’accumulo dei macrofagi
Dopo 7-15 giorni di trattamento si osserva, nella maggior parte dei pazienti, un aumento della creatinina serica non superiore al 20% e generalmente transitorio. Nei casi in cui esso persiste o aumenta di entità è necessario interrompere la somministrazione del farmaco (stenosi arterie renali). Gli Inibitori dell’angiotensina II sono sovrapponibili agli ACEi ma con minori effetti collaterali. I Ca-antagonisti soprattutto i non-diidropiridinici (verapamil) hanno un effetto antiproteinurico e reno-protettivo, indipendentemente dai valori pressori. Gli altri anti-ipertensivi sono utili soltanto per ridurre la pressione arteriosa.
Conclusioni
Identificare i pazienti diabetici che presentano escrezione urinaria di proteine, seguirne l’evoluzione ed adottare opportuni provvedimenti terapeutici, può essere compito di un MMG attento e capace di ritardare la progressione dell’insufficienza renale terminale cronica.
Bibliografia:
1- Società Italiana di Nefrologia. The Italian Registry of Dialisis and Transplantion. Available from: URL: http://www.sin-italia.org
2- V Report del registro Apulo-Lucano di dialisi e trapianto. Atti del XVIII Convegno Apulo-Lucano di Nefrologia
3- G. Colucci, P. Iacovazzo, F. Pavone et al. Gestione integrata del paziente con nefropatia cronica: una proposta di screening per il medico di famiglia. Atti del congresso Giornate Nefrologiche Romane 2004, pag. 59
4- Viberti GC, Mogensen CE, Passa P, et al. St Vincent declaration, 1994. Guidelines for the prevention of diabetic renal failure. In: Mogensen CE (ed). “The kidney and hypertension in diabetes mellitus”, 2nd ed. Boston: Dordrecht/London: Kluwer, 1994; 515-527
5- Deferrari, Cavallo Perin P, Di Paolo S, Locatelli R, Nosadini R, Penno G, Piccoli G, Robaudo C.: Linee guida della nefropatia diabetica. Giornale Italiano di Nefrologia 17:47-58,2000
6- Storia naturale della nefropatia diabetica nel diabete mellito insulino-dipendente. (De Franzo RA. Diabets and the Kidney. In diabetes mellitus: management and complication. Olfeski JM, Sherwin RS, eds New York: Churchill Livingstone,1985:169).
7- Mogensen CE. Hyperfiltration, hypertension, and diabetic nephropathy in IDDM patients. Based on the Golgi Lecture 1988, EASD Meeting, Paris. Diabetes Nutrition & Metabolism 1989;2:227-224
8- Mogensen CE. Microalbuminuria, blood pressure and diabetic renal disease: origin and development of ideas. Diabetologia 1999; 42:263-285
9- Mogensen CE, Christensen CK. Predicting diabetic nephropathy in insulin-dependent patients. N Engl J Med 1984; 311: 89-93
10- Thomas SM, Viberti GC. Is it possible to predict diabetic kidney disease? J Endocrinol Invest 2000; 23:44-53
11- Mogensen CE, Christensen CK. The course of incipient diabetic nephropathy: studies of albumin excretion and blood pressure. Diabetic Med 1985; 2: 97-102
12- Feldt-Rasmussen B, Mathiesen ER, Jensen T, et al. Effect of improved metabolic control on loss of kidney function in type 1 (insulin-dependent) diabetic patients: an update of the Steno studies. Diabetologia 1991; 34:164-170
13- Mathiesen ER, Hommel E, Giese J, Parving HH. Efficacy of captopril in postponing nephropathy insulin-dependent diabetic patients with microalbuminuria. BMJ 1991; 303:81-87
14- Mogensen CE. Glomerular hyperfiltration in human diabetes. Diabetes Care 1994 ;17 : 770-775
15- Yip JW, Jones SL, Wiseman MJ, et al. Glomerular hyperfiltration in the prediction of nephropathy in IDDM: a 10-year follow-up study. Diabetes 1996; 45:1729-1733
16- Jones SL, Wiseman MJ, Viberti GC. Glomerular hyperfiltration as a risk factor for diabetic nephropathy: five-year report of a prospective study. Diabetologia 1991; 34: 59-60
17- Silverio SP; Friedman R, Gross JL. Glomerular hyperfiltration in IDDM patients without overt proteinuria. Diabetes Care 1993; 16:115-119
18- Vedel P, Opel J, Nielsen FN, et al. Glomerular hyperfiltration in microalbuminuric NIDDM patients. Diabetologia 1996; 39: 1584-1589
19- Nielsen S. Systolic blood pressure relates to the rate of decline of glomerular filtration rate in type 2 diabetes mellitus. Diabetes Care 1993; 16:1427-1432
20- Passavanti G, Ramunni A, Saracino A, Fassianos E, Morrone LF, Coratelli P. Atti del congresso Insufficienza Renale Cronica. Giornate Nefrologiche Romane 2002
Colucci Giovanni
Medico di Medicina Generale